 |
Címdokumentumok térképe |
|
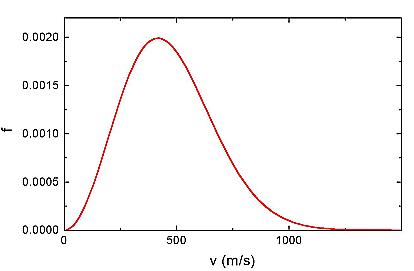 |
atomos gáz kinetikus tulajdonságai –
Gázok nyomását először Bernoulli magyarázta úgy, mint kis részecskéknek (atomok, molekulák) a fallal történő rugalmas ütközések során kifejtett erőhatása. Gázokban és folyadékokban lévő kis részecskék Brown-mozgása is az atomi ütközések következménye. Newton mozgástörvényeit alkalmazva igazolták, hogy az atomok, molekulák átlagos mozgási energiája a gázban az abszolút hőmérséklettel arányos: 3/2 · kT (k = 1,38 · 10-23 joule/Kelvin a Boltzmann-állandó, T az abszolút hőmérséklet. Az ekvipartíció tétele szerint az átlagos hőmérsékleti energia egy szabadságfokra 1/2 · kT, az atomok és molekulák térbeli mozgásánál a szabadságfokok száma 3. A kinetikus elmélet azt is igazolta, hogy a gáz nyomása arányos az átlagos mozgási energiával. Bár az egyes atomok mozgását leírni rendkívül bonyolult feladat lenne, Maxwell realizálta, hogy a gázok makroszkopikus tulajdonságai az eloszlásfüggvénnyel írhatóak le. A Maxwell-féle eloszlásfüggvény azt adja meg, hogy a gázban egy atom vagy molekula sebessége milyen valószínűséggel lesz egy adott v érték. Hőmérsékleti egyensúlyban lévő gázra az eloszlásfüggvény időtől független. Maxwell elméletét Boltzmann általánosította (statisztikus fizika). Ha egy rendszert hőmérsékleti egyensúlyából kitérítenek, az egy relaxációs idővel tér vissza egyensúlyi állapotába. A relaxációs idő fontos szerepet játszik a vezetési jelenségeknél (pl. hő- és elektromos vezetés).
|
Összeállította: Papp Elemér Utolsó frissítés: 2004. szeptember 24. © 2004 MTA |
| Kapcsok a világháló felé | ||
| ¬ Nyitóoldal ® |